Gaston Bachelard disait que la vérité est presque toujours « une erreur rectifiée » et, modestement, j’adhère… Du moins, je pense que l’erreur, si elle n’est pas toujours nécessaire, s’intègre au moins naturellement au processus de qualification de « l’évident ».
Voilà mon sarcasme nuancé en bloc par anticipation, nous allons donc pouvoir maintenant nous amuser ensemble de ce que l’observation et la déduction scientifique ont pu accoucher de plus saugrenu.
Dans ce petit Best Of (très personnel) des plus ‘belles’ erreurs scientifiques, nous allons voir en 7 parties comment l’apprentissage et la déduction ont pu parfois malmener les plus grands esprits de ce monde.
Une façon ludique de s’intéresser au façonnage de la science à travers l’histoire.
La science du XVIIIème siècle – Contexte
Dans le précédent billet du petit bêtisier scientifique, nous nous étions arrêtés en 1585 et aux balbutiements de la physique moderne. Grâce à Galilée, nous comprenions pour la première fois qu’étudier la vitesse d’un objet ne permet pas de déterminer si des forces lui sont appliquées.
A peine une génération plus tard, Newton va transformer l’essai avec la conclusion suivante:
Si la vitesse d’un corps ne permet pas de déterminer les forces qu’il subit, la variation de sa vitesse, quant à elle, le permet.
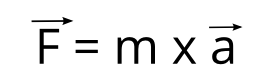
Newton va alors formaliser les équations de la mécanique et poser, avec Leibniz, les bases du calcul différentiel et intégral.
Les deux siècles qui nous séparent du sujet d’aujourd’hui vont alors être riches en découvertes.
Torricelli (l’élève de Galilée) va inventer le baromètre ce qui va le conduire à mettre en évidence le premier vide permanent et lui permettre de vérifier la théorie de son maître sur la chute des corps. Blaise Pascal va significativement faire avancer la connaissance scientifique en probabilité et mécanique des fluides. L’électromagnétisme va doucement émerger lui aussi grâce à Coulomb et Volta (inventeur de la pile électrique). Enfin, la biologie va se développer princièrement au 18ème siècle grâce aux travaux de Buffon et Lamarck.
A cette époque, on assiste aussi progressivement à la mort de l’alchimie et c’est dans ce contexte que s’inscrit l’erreur dont je vais vous parler aujourd’hui.
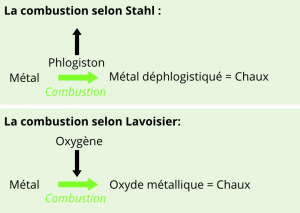
La théorie phlogistique
A l’origine de la phlogistique se trouve une question simple encore non résolue à la fin du 17ème siècle : « pourquoi certains corps brûlent et d’autres non? ». Il faut dire que le moyen-âge et l’inquisition sont passés par là, et que l’Homme est manifestement passé maître dans l’art de faire brûler des trucs.
Deux scientifiques allemands (J.J Becher puis G.E Stahl) vont alors successivement s’intéresser à la question et élaborer une théorie basée sur un fait observable : un corps semble perdre de la masse en brûlant.
La théorie établit alors que toute matière contient du phlogiston, une substance incolore et inodore qui s’échappe lors de la combustion pour peu qu’il dispose d’un endroit où s’échapper (par exemple : l’air). Plus une matière contient du phlogiston, plus elle est inflammable. A ce titre, le charbon et le dihydrogène contiennent du phlogiston presque pur.
En fait, l’idée de matérialiser la chaleur et notamment le feu n’est pas nouvelle. Aristote, 2 millénaires plus tôt, déclarait avec autorité que toute chose sur terre était composée de quatre éléments: l’eau, la terre, l’air et le feu… Comme quoi, quand un scientifique se trompe quelque part dans le monde, Aristote n’est jamais vraiment loin.
Les détracteurs de la théorie
La théorie phlogistique va séduire de nombreux intellectuels de l’époque. D’ailleurs, lorsqu’en 1774, Joseph Priestley découvre l’oxygène en faisant chauffer de l’oxyde de mercure dans un tube à essai, il le baptise simplement « air déphlogistiqué ».
Pourtant, un détail préoccupe certains membres de la communauté scientifique et notamment un français nommé Antoine Lavoisier. Le chimiste réprouve particulièrement l’observation fruste selon laquelle tout corps perd de la masse en brûlant.
En effet, déjà à l’époque, les métallurgistes savent que certains métaux (comme le plomb) lorsqu’ils sont chauffés à l’air, forment une chaux qui est plus lourde que le métal initial. Le métal ayant pourtant perdu son phlogiston, comment expliquer qu’il s’alourdisse ?
Cette contradiction manifeste ne suffit pourtant pas à mettre à bas la théorie phlogistique qui reste encore la seule à tenter d’expliquer les phénomènes de combustion.
Lavoisier décide alors d’élaborer sa propre théorie et pour cela il va s’appuyer sur les travaux d’un phlogisticien (Joseph Priestley) qui a notamment permis de mettre en évidence l’existence de l’oxygène.
Et le coup de génie de Lavoisier va consister à ne plus voir la combustion comme la perte d’une substance mais, au contraire, comme la création d’un corps par combinaison d’un combustible avec un gaz: l’oxygène.
Si le gain de masse de certains métaux transformés en chaux s’explique alors, la théorie de Lavoisier permet également de justifier la perte de masse du carbone qui, lors de sa combustion, réagit avec l’oxygène pour former un gaz : le dioxyde de carbone.
L’idée de composer et décomposer des éléments comme l’air ou l’eau est absolument inédite, et la théorie de Lavoisier va donner naissance à ce que les historiens appellent: la « Révolution chimique ».
Quand une erreur en remplace une autre
Pourtant, la nouvelle théorie de Lavoisier ne fait pas complètement l’unanimité. Certains lui reprochent entre autre la façon dont il justifie le dégagement de chaleur.
En effet, quand il décrit sa théorie dans son Traité élémentaire de chimie (1787), Lavoisier explique le dégagement de chaleur accompagnant la combustion d’un corps en faisant appel, lui aussi, à une substance magique : « le calorique » (substance issue d’une nouvelle théorie portée par l’écossais Joseph Black).
Souvent considéré comme un ersatz du phlogiston par ses détracteurs, le calorique est décrit comme un fluide de masse presque nulle imprégnant les corps et notamment capable de faire varier le volume d’un objet lors du passage de son état solide à liquide ou liquide à gaz.
La fin de la phlogistique et du calorique
Pour mettre fin à plus d’un siècle de méprise, il faudra compter sur le travail de deux hommes.
Le premier: Benjamin Thompson (à ne pas confondre avec J.J Thomson: prix Nobel de Physique 1906) publie ses travaux en 1804 sous le titre « Mémoire sur la chaleur » avec la ferme intention d’infliger au calorique ce que Lavoisier a précédemment fait au phlogiston. Malheureusement pour lui, l’ouvrage sera décrié par la communauté scientifique qui lui reprochera son manque de rigueur.
Pour l’anecdote, Benjamin Thomson, alias Lord Rumford, faute d’avoir durablement démoli la théorie de Lavoisier, épousera quand même sa veuve en 1805 et, ironie parisienne, une rue perpendiculaire à la rue Lavoisier sera nommée « rue Rumford ». La voie finira par être supprimée en 1854 lors du percement du boulevard Malesherbes.
Le coup de grâce sera finalement porté en 1840 par un brasseur de bière, un autodidacte britannique du nom de James Joule. Joule s’est particulièrement intéressé à la conversion du travail mécanique en chaleur, et ses résultats vont notamment permettre de conclure quant à la vraie nature de la chaleur. Pour la première fois, la chaleur est perçue, au même titre que le travail, comme une forme d’énergie et non un fluide.
Références:
http://www.acs.org/content/acs/en/education/whatischemistry/landmarks/lavoisier.html
http://histoires-de-sciences.over-blog.fr/article-31362064.html
http://www.larecherche.fr/idees/histoire-science/calorique-ou-erreur-lavoisier-01-12-2013-165001
Remarque:
J’ai trouvé assez amusant, qu’à ce jour, il ne soit pas fait explicitement référence à la théorie du calorique sur la page Wikipedia française d’Antoine Lavoisier. Pourtant, le chimiste y faisait clairement appel dans son traité élémentaire de chimie:
« Nous savons, en général, que tous les corps de la nature sont plongés dans le calorique, qu’ils en sont environnés, pénétrés de toutes parts, et qu’il remplit tous les intervalles que laissent entre elles leurs molécules : que, dans certains cas le calorique se fixe dans les corps, de manière même à constituer leurs parties solides; mais que le plus souvent il en écarte les molécules, il exerce sur elles une force répulsive, et que c’est de son action ou de son accumulation plus ou moins grande que dépend le passage des corps de l’état solide à l’état liquide, de l’état liquide à l’état aériforme. » – Antoine Laurent de Lavoisier, Traité élémentaire de chimie